Схема строения электронной оболочки алюминия, § 2. Строение электронных оболочек атомов

Внешним считается 4 электронный уровень, на нем у нас один неспаренный электрон 4s 1 , вариант ответа нам также подойдет. Стрелочками обозначены электроны, которые занимают атомные орбитали. Копирование материалов с сайта возможно только с разрешения администрации портала и при наличие активной ссылки на источник. Итак, у атома железа внешний электронный уровень — четвертый, внешние подуровни — 4 s -, 4 p -, 4 d - и 4 f -ЭПУ, внешние орбитали — 4 s -, 4 p -, 4 d - и 4 f -АО, внешние электроны — два 4 s -электрона 4 s 2 , внешний электронный слой — четвертый, внешнее электронное облако — 4 s -ЭО валентные подуровни — 4 s -, 4 p -, и 3 d -ЭПУ, валентные орбитали — 4 s -, 4 p -, и 3 d -АО, валентные электроны — два 4 s -электрона 4 s 2 и шесть 3 d -электронов 3 d 6. Особенности электронного строения атома углерода В м классе вы будете изучать органическую химию — химию соединений углерода.
Электронные конфигурации атомов. Электронные конфигурации атомов I — IV периодов периодической таблицы Д. Особо следует отметить палладий, у которого «проскок» двух электронов:. Завершенный внешний электронный уровень обладает наибольшей устойчивостью и обусловливает химическую инертность благородных газов. Атомы остальных химических элементов имеют незавершенные внешние электронные уровни. Электронные семейства химических элементов. Отметим, что принцип наименьшей энергии справедлив только для основного состояния атома, характеризующегося минимумом энергии.
В возбуждённых состояниях электроны могут занимать любые орбитали атома, если при этом не нарушается принцип Паули. При получении энергии извне, например, при облучении или нагревании, один или несколько электронов могут повышать свою энергию и переходить на более высокие энергетические уровни. Такие состояния атома называются возбуждёнными. Возбуждённое состояние атома углерода. В отличие от азота, кислорода и фтора у атомов элементов тех же соответствующих главных подгрупп — фосфора , серы и хлора — возможен переход атомов в возбуждённое состояние.
Вследствие этого фосфор, в отличие от азота может быть пятивалентным, сера, в отличие от кислорода — шестивалентной, а хлор, в отличие от фтора — семивалентным. Например, распаривание электронов в атоме фосфора при переходе в возбужденное состояние можно изобразить схемой:.
Основное и возбуждённое состояние атома фосфора. Заполнение электронных орбиталей происходит в соответствии с принципом Паули, правилом Хунда и принципом наименьшей энергии. Согласно принципу Паули, в атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел. Согласно правилу Хунда, в основном наиболее устойчивом состоянии в пределах одного подуровня атом должен иметь максимально возможное число неспаренных электронов.
Согласно принципу наименьшей энергии, электроны заполняют электронные орбитали в порядке увеличения их энергии. Охарактеризуйте свойства электрона, которые свидетельствуют о его двойственной природе. Сформулируйте принципы, в соответствии с которыми происходит заполнение электронных орбиталей в атоме. Поясните, почему элементы одной подгруппы обладают сходными свойствами. Как вы считаете, можно ли предсказать свойства элемента, зная электронное строение его атомов?
Составьте электронные конфигурации атомов серы и хлора в основном и возбуждённом состоянии. Возможно ли аналогичное возбуждённое состояние для атомов кислорода и фтора. Аргументируйте свой ответ. Номер периода в Периодической системе химических элементов Д. Менделеева равен числу :. Меню Подобрать занятия. Учебник Избранные статьи. Скачайте мобильное приложение и читайте Фоксфорд Учебник на телефоне и планшете.
В конце статьи. Прочитайте теорию ниже и проверьте с помощью задачи, поняли ли вы материал. Строение электронных оболочек. Посмотрите видео-объяснение темы Преподаватель Фоксфорда всё подробно расскажет и покажет.
Чтобы посмотреть, нужно зарегистрироваться. Содержание Понятие электронной орбитали. Электронная орбиталь атомная орбиталь.
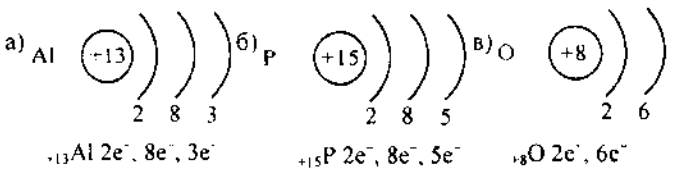
Электроны занимают уровни последовательно, в порядке увеличения их энергии принцип наименьшей энергии. Число энергетических уровней в атоме равно номеру периода , в котором находится элемент.
В этом заключается физический смысл номера периода в таблице Д. Химические свойства определяются не всеми электронами, а только теми, которые обладают наибольшей энергией — так называемыми валентными. Число валентных электронов равно номеру группы. Число валентных электронов определяет принадлежность элемента к металлам или неметаллам, свойства образованных этим элементом соединений и его валентность в этих соединениях. Атомы элементов со сходными свойствами имеют сходное строение внешних электронных уровней, например: щелочные металлы содержат на внешнем уровне один электрон, углерод и кремний — четыре, галогены — семь.
С увеличением порядкового номера элемента число валентных электронов периодически повторяется, что обусловливает периодическое изменение свойств элементов и их соединений. Коротко о главном Электрон имеет двойственную природу, обладая свойствами как частицы, так и волны. Вопросы для самоконтроля Охарактеризуйте свойства электрона, которые свидетельствуют о его двойственной природе.
Содержание Двойственная природа электрона. Завершённые энергетические уровни. Незавершённые энергетические уровни. Находятся в нижней части таблицы. Какой электронный уровень называется завершённым? Решите задачу, чтобы проверить, поняли ли вы тему. Уровень сложности. Попытка 1 из 1. Понятно Непонятно Войдите или зарегистрируйтесь , чтобы голосовать.
А еще вы сможете сохранять статьи в «избранное» и смотреть видеоуроки. Следующая статья. Строение атома. Выбирайте, что поможет вам достичь целей. Я — Мистер Фокс, ваш онлайн-помощник. Ответьте на несколько вопросов, а я помогу за 5 минут подобрать подходящие варианты обучения. Это бесплатно! Как и в предыдущих случаях, здесь вместо первой клеточки ставится номер периода равен главному квантовому числу этих s -электронов.
Число во второй клеточке оказывается на единицу меньше, так как на единицу меньше главное квантовое число этих d -электронов. Номер группы здесь тоже равен сумме индексов.
Пример — валентная электронная формула титана 4-й период, IVB группа : 4 s 2 3 d 2. Номер группы равен сумме индексов и для элементов VIB группы, но у них, как вы помните, на валентном s -подуровне всего один электрон, и общая валентная электронная формула ns 1 n —1 d 5. Поэтому валентная электронная формула, например, молибдена 5-й период — 5 s 1 4 d 5. Общая валентная электронная формула атомов элементов IIB группы — ns 2 n — 1 d Поэтому валентная электронная формула, например, атома цинка — 4 s 2 3 d Общим правилам подчиняются и валентные электронные формулы элементов первой триады Fe, Co и Ni.
У атома кобальта — на один d -электрон больше 4 s 2 3 d 7 , а у атома никеля — на два 4 s 2 3 d 8. Пользуясь только этими правилами написания валентных электронных формул, нельзя составить электронные формулы атомов некоторых d -элементов Nb, Ru, Rh, Pd, Ir, Pt , так как у них за счет стремления к высокосимметричным электронным оболочкам заполнение электронами валентных подуровней имеет некоторые дополнительные особенности.
Зная валентную электронную формулу, можно записать и полную электронную формулу атома см. Часто вместо громоздких полных электронных формул записывают сокращенные электронные формулы атомов. Для их составления в электронной формуле выделяют все электроны атома кроме валентных, помещают их символы в квадратные скобки и часть электронной формулы, соответствующую электронной формуле атома последнего элемента предшествующего периода элемента, образующего благородный газ , заменяют символом этого атома.
Для элементов 2-го и 3-го периодов третья операция без четвертой сразу приводит к полной электронной формуле. Составьте валентную электронную формулу атома элемента а второго периода третьей А группы, б третьего периода второй А группы, в четвертого периода четвертой А группы.
Составьте сокращенные электронные формулы атомов магния, фосфора, калия, железа, брома и аргона. За с лишним лет, прошедших с момента открытия естественной системы элементов, было предложено несколько сотен самых разнообразных таблиц, графически отражающих эту систему.
Из них, кроме длиннопериодной таблицы, наибольшее распространение имеет так называемая короткопериодная таблица элементов Д. Короткопериодная таблица получается из длиннопериодной, если 4-й, 5-й, 6-й и 7-й периоды разрезать перед элементами IB группы, раздвинуть и получившиеся ряды сложить так, как раньше мы складывали периоды.
Результат изображен на рисунке 6. В группах этой таблицы собраны элементы, у атомов которых одинаковое число валентных электронов независимо от того, на каких орбиталях находятся эти электроны. Так, элементы хлор типичный элемент, образующий неметалл; 3 s 2 3 p 5 и марганец элемент, образующий металл; 4 s 2 3 d 5 , не обладая подобием электронных оболочек, попадают здесь в одну и ту же седьмую группу.
Необходимость различать такие элементы заставляет выделять в группах подгруппы : главные — аналоги А-групп длиннопериодной таблицы и побочные — аналоги В-групп. На рисунке 34 символы элементов главных подгрупп сдвинуты влево, а элементов побочных подгрупп — вправо.
Правда, такое расположение элементов в таблице имеет и свои преимущества, ведь именно числом валентных электронов в первую очередь определяются валентные возможности атома. Длиннопериодная таблица отражает закономерности электронного строения атомов, сходство и закономерности изменения свойств простых веществ и соединений по группам элементов, закономерное изменение ряда физических величин, характеризующих атомы, простые вещества и соединения по всей системе элементов и многое другое.
Короткопериодная таблица в этом отношении менее удобна. Преобразуйте построенную вами из естественного ряда элементов длиннопериодную таблицу в короткопериодную.
Проведите обратное преобразование. Можно ли составить общую валентную электронную формулу атомов элементов одной группы короткопериодной таблицы? Четких границ у атома нет. Что же считать размером изолированного атома? Ядро атома окружено электронной оболочкой, а оболочка состоит из электронных облаков.
Размер ЭО характеризуется радиусом r эо. Все облака внешнего слоя имеют примерно одинаковый радиус. Следовательно, размер атома можно охарактеризовать этим радиусом. Он называется орбитальным радиусом атома r 0. Значения орбитальных радиусов атомов приведены в приложении 5. Радиус ЭО зависит от заряда ядра и от того, на какой орбитали находится электрон, образующий это облако.
Следовательно, и орбитальный радиус атома зависит от этих же характеристик. Рассмотрим электронные оболочки атомов водорода и гелия. И в атоме водорода, и в атоме гелия электроны находятся на 1 s -АО, и их облака имели бы одинаковые размеры, если бы заряды ядер этих атомов были одинаковы. Но заряд ядра атома гелия в два раза больше, чем заряд ядра атома водорода.
По закону Кулона сила притяжения, действующая на каждый из электронов атома гелия, в два раза больше силы притяжения электрона к ядру атома водорода. Следовательно, радиус атома гелия должен быть намного меньше радиуса атома водорода. У атома лития внешний электрон находится на 2 s -АО, то есть, образует облако уже второго слоя.
Естественно, что его радиус должен быть больше. У атомов остальных элементов второго периода внешние электроны и 2 s , и 2 p размещаются в том же втором электронном слое, а заряд ядра у этих атомов с увеличением порядкового номера увеличивается. Электроны сильнее притягиваются к ядру, и, естественно, радиусы атомов уменьшаются. Мы могли бы повторить эти рассуждения и для атомов элементов остальных периодов, но с одним уточнением: монотонно уменьшается орбитальный радиус только при заполнении каждого из подуровней.
Но если отвлечься от частностей, то общий характер изменения размеров атомов в системе элементов следующий: с увеличением порядкового номера в периоде орбитальные радиусы атомов уменьшаются, а в группе — увеличиваются. Самый большой атом — атом цезия, а самый маленький — атом гелия, но из атомов элементов, образующих химические соединения гелий и неон их не образуют , самый маленький — атом фтора. У большинства атомов элементов, стоящих в естественном ряду после лантаноидов, орбитальные радиусы несколько меньше, чем следовало бы ожидать, опираясь на общие закономерности.
Это связано с тем, что между лантаном и гафнием в системе элементов расположены 14 лантаноидов, и, следовательно, заряд ядра атома гафния на 14 е больше, чем у лантана. Поэтому внешние электроны этих атомов притягиваются к ядру сильнее, чем притягивались бы при отсутствии лантаноидов этот эффект часто называют "лантаноидным сжатием".
Обратите внимание, что при переходе от атомов элементов VIIIA группы к атомам элементов IA группы орбитальный радиус скачкообразно увеличивается.
Следовательно, наш выбор первых элементов каждого периода см. По данным, приведенным в приложении 5, постройте на миллиметровой бумаге график зависимости орбитального радиуса атома от порядкового номера элемента для элементов с Z от 1 до Длина горизонтальной оси мм, длина вертикальной оси мм.
Как можно охарактеризовать вид получившейся ломаной линии? Если сообщить электрону в атоме дополнительную энергию как это можно сделать, вы узнаете из курса физики , то электрон может перейти на другую АО, то есть атом окажется в возбужденном состоянии. Это состояние неустойчиво, и электрон почти сразу же вернется в исходное состояние, а избыточная энергия выделится. Но если сообщенная электрону энергия достаточно велика, электрон может совсем оторваться от атома, атом при этом ионизируется , то есть, превращается в положительно заряженный ион катион.
Энергия, необходимая для этого, называется энергией ионизации атома E и. Оторвать электрон от единственного атома и измерить необходимую для этого энергию довольно сложно, поэтому практически определяют и используют молярную энергию ионизации E и m.
Молярная энергия ионизации показывает, какова наименьшая энергия, которую необходимая для отрыва 1 моля электронов от 1 моля атомов по одному электрону от каждого атома. Эта величина обычно измеряется в килоджоулях на моль.
Значения молярной энергии ионизации первого электрона для большинства элементов приведены в приложении 6. Как же зависит энергия ионизации атома от положения элемента в системе элементов, то есть, как она изменяется в группе и периоде?
По физическому смыслу энергия ионизации равна работе, которую нужно затратить на преодоление силы притяжения электрона к атому при перемещении электрона из атома на бесконечное от него расстояние. Приближенно эту работу можно считать работой по преодолению сил электростатического притяжения, тогда она равна. И q , и Q — величины постоянные, и можно сделать вывод, что, работа по отрыву электрона А , а вместе с ней и энергия ионизации Е и , обратно пропорциональны орбитальному радиусу атома.
Проанализировав значения орбитальных радиусов атомов различных элементов и соответствующие им значения энергии ионизации, приведенные в приложениях 5 и 6, вы можете убедиться, что зависимость между этими величинами близка к пропорциональной, но несколько от нее отличается.
Причина того, что наш вывод не очень хорошо согласуется с экспериментальными данными, в том, что мы воспользовались очень грубой моделью, не учитывающей многих существенных факторов. Но даже эта грубая модель позволила нам сделать правильный вывод о том, что с увеличением орбитального радиуса энергия ионизации атома уменьшается и, наоборот, с уменьшением радиуса — возрастает.
Так как в периоде с увеличением порядкового номера орбитальный радиус атомов уменьшается, то энергия ионизации — возрастает. В группе же с увеличением порядкового номера орбитальный радиус атомов, как правило, увеличивается, а энергия ионизации уменьшается. В системе элементов направление увеличения энергии ионизации можно схематически показать так:. В химии важно то, что энергия ионизации характеризует склонность атома к отдаче "своих"электронов: чем больше энергия ионизации, тем менее склонен атом отдавать электроны, и наоборот.
Используя данные, приведенные в приложении 6, определите, какую энергию нужно затратить, чтобы оторвать по одному электрону от всех атомов натрия общей массой 1 г. Используя данные, приведенные в приложении 6, определите, во сколько раз больше энергии нужно затратить для отрыва по одному электрону от всех атомов натрия массой 3 г, чем от всех атомов калия такой же массы.
Почему это отношение отличается от отношения молярных энергий ионизации этих же атомов? По данным, приведенным в приложении 6, постройте график зависимости молярной энергии ионизации от порядкового номера для элементов с Z от 1 до Размеры графика те же, что и в задании к предыдущему параграфу. Проследите, соответствует ли этот график выбору "периодов"системы элементов.
Вторая важнейшая энергетическая характеристика атома — энергия сродства к электрону E с. На практике, как и в случае энергии ионизации, обычно используют соответствующую молярную величину — молярную энергию сродства к электрону. Молярная энергия сродства к электрону показывает, какова энергия, выделяющаяся при присоединении одного моля электронов к одному молю нейтральных атомов по одному электрону к каждому атому.
Как и молярная энергия ионизации, эта величина тоже измеряется в килоджоулях на моль. На первый взгляд может показаться, что энергия при этом выделяться не должна, ведь атом — это нейтральная частица, и никаких электростатических сил притяжения между нейтральным атомом и отрицательно заряженным электроном нет. Наоборот, приближаясь к атому, электрон, казалось бы, должен отталкиваться от таких же отрицательно заряженных электронов, образующих электронную оболочку. На самом деле это не совсем так.
Вспомните, приходилось ли вам когда-либо иметь дело с атомарным хлором. Конечно, нет. Ведь он существует только при очень высоких температурах. Практически не встречается в природе даже более устойчивый молекулярный хлор — при необходимости его приходится получать с помощью химических реакций.
А с хлоридом натрия поваренной солью вам приходится иметь дело постоянно. Ведь поваренная соль каждый день потребляется человеком с пищей.
И в природе она встречается довольно часто. Но ведь в состав поваренной соли входят хлорид-ионы, то есть атомы хлора, присоединившие по одному "лишнему"электрону. Одна из причин этого такой распространенности хлорид-ионов состоит в том, что атомы хлора обладают склонностью к присоединению электронов, то есть при образовании хлорид-ионов из атомов хлора и электронов выделяется энергия. Одна из причин выделения энергии вам уже известна — она связана с возрастанием симметрии электронной оболочки атома хлора при переходе к однозарядному аниону.
При этом, как вы помните, энергия 3 p -подуровня уменьшается. Есть и другие более сложные причины. В связи с тем, что на значение энергии сродства к электрону влияет несколько факторов, характер изменения этой величины в системе элементов значительно более сложный, чем характер изменения энергии ионизации. В этом вы можете убедиться, проанализировав таблицу, приведенную в приложении 7.
Но так как значение этой величины определяется, прежде всего, тем же электростатическим взаимодействием, что и значения энергии ионизации, то и изменение ее в системе элементов по крайней мере в А-группах в общих чертах сходно с изменением энергии ионизации, то есть энергия сродства к электрону в группе уменьшается, а в периоде — возрастает.
Характер изменения энергии сродства к электрону в системе элементов напоминает характер изменения энергии ионизации, то есть направление увеличения энергии сродства к электрону можно схематически показать так:.
В химии важно, что энергия сродства к электрону характеризует склонность атома к присоединению "чужих"электронов. Значения молярной энергии сродства к электрону для атомов большинства элементов приведены в приложении 7. Отмеченный нами характер изменения энергетических характеристик в группах и периодах основан на очень сильно упрощенных рассуждениях, но даже так мы получили результаты, в общих чертах согласующиеся с действительностью. Убедитесь в этом сами, проанализировав таблицы значений и приложения 6 и 7.
Чему равна энергия, выделяющаяся при присоединении одного моля электронов к а одному молю атомов хлора, б к 1 г атомов хлора? В том же масштабе по горизонтальной оси, что и в предыдущих заданиях, постройте график зависимости молярной энергии сродства к электрону от порядкового номера для атомов элементов с Z от 1 до 40, используя приложение 7. Какой физический смысл имеют отрицательные значения энергии сродства к электрону?
Почему из всех атомов элементов 2-го периода отрицательные значения молярной энергии сродства к электрону имеют только бериллий, азот и неон? Вы уже знаете, что склонность атома отдавать свои и присоединять чужие электроны зависит от его энергетических характеристик энергии ионизации и энергии сродства к электрону. Какие же атомы более склонны отдавать свои электроны, а какие — принимать чужие?
Для ответа на этот вопрос сведем в таблицу 15 все, что нам известно об изменении этих склонностей в системе элементов. Таблица Изменение склонности атомов к отдаче своих и присоединению чужих электронов. Склонность Направление возрастания в периодах в А-группах в системе элементов к отдаче своих электронов к присоединению чужих электронов Наиболее склонны отдавать свои электроны атомы элементов IА группы и особенно атомы цезия самые большие.
Наиболее склонны принимать чужие электроны атомы элементов VIIA группы и особенно атомы фтора и хлора самые маленькие. Атомы благородных газов не склонны ни отдавать электроны, ни принимать их. Теперь рассмотрим, сколько же электронов атом может отдать. Во-первых, в химических реакциях атом может отдавать только валентные электроны, так как отдавать остальные энергетически крайне невыгодно. Во-вторых, атом "легко"отдает если склонен только первый электрон, второй электрон он отдает значительно труднее в раза , а третий — еще труднее в раз.
Таким образом, атом может отдать один, два и, значительно реже, три электрона. А сколько электронов атом может принять? Во-первых, в химических реакциях атом может принимать электроны только на валентные подуровни. Во-вторых, выделение энергии происходит только при присоединении первого электрона и то далеко не всегда.
Присоединение второго электрона всегда энергетически невыгодно, а третьего — тем более. Тем не менее, атом может присоединить один, два и крайне редко три электрона , как правило, столько, сколько ему не хватает для заполнения своих валентных подуровней. Энергетические затраты на ионизацию атомов и на присоединение к ним второго или третьего электрона компенсируются за счет энергии, выделяющейся при образовании химических связей.
В результате потери или присоединения электронов атом перестает быть электронейтральным и превращается в заряженную частицу, называемую ионом.
Правый верхний индекс у символа элемента показывает значение электрического заряда иона. То же относится и к отрицательным зарядам. Как меняется электронная оболочка у атомов калия, кальция и скандия при отдаче ими своих электронов?
Приведите уравнения отдачи атомами электронов и сокращенные электронные формулы атомов и ионов. Как меняется электронная оболочка у атомов хлора, серы и фосфора при присоединении ими чужих электронов?
Приведите уравнения присоединения электронов и сокращенные электронные формулы атомов и ионов.

Используя приложение 7, определите, какая энергия выделится при присоединении электронов ко всем атомам натрия общей массой 1 г. Используя приложение 7, определите, какую энергию необходимо затратить для отрыва "лишних"электронов у 0,1 моля ионов Br—? Внешние электроны — электроны внешнего электронного слоя. Валентные подуровни — электронные подуровни атома, на которых находятся, или могут находиться "свои "или "чужие "валентные электроны при образовании атомом химических связей.
Валентные орбитали — атомные орбитали, образующие валентные подуровни. Орбитальный радиус атома, — радиус электронных облаков внешнего электронного слоя.
Энергия ионизации атома — энергия, которую необходимо затратить, чтобы оторвать электрон от атома.