Электролиз воды на катоде, В Стэнфорде улучшили чистый способ хранить возобновляемую энергию / Хабр

Не знаю, почему электролиз воды Вы хитро назвали "прямым", для меня это традиционный электролиз воды. Если у вас простая вода, то её можно очистить более простыми методами, а если цветущий зеленью колодец с плохим бак. После того как на аноде выделилось 4,48 л н. При изменении направления тока катод и анод меняются местами, развитие процессов идет в противоположном направлении.
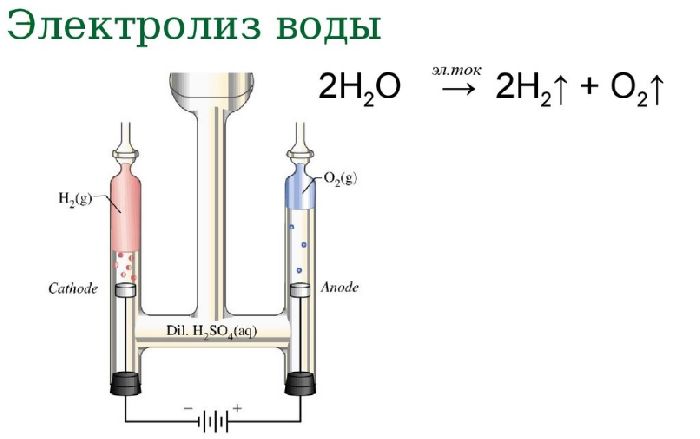
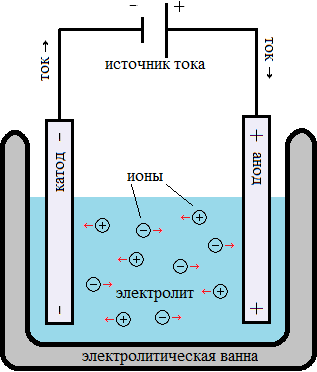
Процесс электролиза воды выглядит следующим образом: два электрода опускаются в воду, затем по ним пропускают электроток, и на их поверхности выступают пузырьки составляющих воду элементов. Но для этого процесса необходим катализатор на электродах, и традиционно это платина, довольно дорогое решение.
Именно замена этого редкого металла на что-либо более доступное нужна для удешевления процесса электролиза. В немецком научном журнале Angewandte Chemie Харамильо и Кибсгаард описали чистый, надёжный и эффективный заменитель драгоценному металлу.
И их намерения выходят далеко за пределы текущего рынка химической промышленности. Сейчас использование солнечных батарей во многом упирается в хранение и преобразование энергии, распространённые и дешёвые системы которых найти довольно трудно. Исследователи из Стэнфорда считают, что им под силу превратить баки с водой в аккумуляторы. Днём солнечные батареи будут производить электроэнергию, а её излишки будут использоваться для выработки водорода и кислорода.
Ночью эти газы снова соединяются в воду в топливных ячейках, вырабатывая электроэнергию для потребителей электрической сети. В отличие от аккумуляторов, которые включают в свой состав электролит, потенциально несущий огромный вред для экологии при его неправильной утилизации, такое хранение — чистое и относительно безопасное. На наноуровне платина в процессе электролиза закрепляет голый протон потерявшего свой электрон атома водорода до той поры, пока атом водорода не сможет подобрать электрон для формирования молекулы H 2 в паре с другим таким же атомом водорода.
И загвоздка состоит в том, чтобы найти катализатор с определённой силой связи: если она слишком слаба, то атом водорода не удержится, если она будет слишком сильной, то он так и не будет отпущен. Платина для этих целей подходит идеально, но в прошлом году в Стэнфорде было обнаружено , что её аналогом может быть вариант сульфида молибдена, катализатора, широко используемого в переработке нефти для крэкинга тяжёлых углеводородов.
Оказалось, что некоторые из его свойств подходят хорошо.

Кроме этого катализатора исследователи также позаимствовали у индустрии нефтеперегонки и другой трюк. По экологическим причинам во время обработки из нефти часто удаляют серу для снижения частоты кислотных дождей. Крышку следует оборудовать тремя отверстиями: двуми для закрепления пластин и одним для газоотводящего штуцера.
После этого, путем вырезания, формируются две пластины, которые закрепляются с помощью изоляционных прокладок к крышке, аналогично и с штуцером.
Все места соединений тщательно проклеиваются герметиком. Затем в банку наливается электролит процесс изготовления электролита будет описан ниже , крышка надевается на банку, опять-таки с применением герметика, и подключаются клеммы для подачи питания. Таким образом, собирается сырой электролизер. Сначала производится вырезание 7 пластин для вольтовой схемы, а также 2 боковых пластин, которые могут быть изготовлены из оргстекла или нержавеющей стали толщиной около 4 мм.
Кроме того, нужно подготовить 8 резиновых прокладок шириной стенок 1 см. Эти компоненты будут использованы для сборки электролизера.
Сборка производится следующим образом: боковая пластина, резиновая прокладка, пластина, резиновая прокладка, и так далее, пока все пластины не будут собраны. Затем все это крепится болтами, и важно изолировать болты от корпуса. Сначала устанавливаются угловые болты и затягиваются аккуратно, чтобы избежать искривления конструкции.
Затем устанавливаются серединные болты, затягиваются, и после этого устанавливаются оставшиеся болты. Далее, в боковую пластину вкручиваются 2 штуцера: один для вывода газа, а другой для циркуляции воды. Это позволяет легче управлять пеной, которая может образовываться во время электролиза.
Пена попадает в бак циркуляции, где может быть устранена, а газ продолжает движение. Электролизер также может быть заполнен эпоксидной смолой, чтобы выдерживать более высокое давление, до атмосфер. Важно также учесть, что диаметр отверстий для циркуляции газа и жидкости должен быть подобран в зависимости от скорости выделения газа, чтобы предотвратить газозаполнение.
Вот некоторые рекомендуемые размеры для отверстий:. Изготовление ячейки Стэнли Мейера состоит из двух трубок, вставленных друг в друга, в качестве рабочего тела. Процесс изготовления сырого электролизера похож на этот процесс. Количество таких ячеек зависит от необходимой мощности, но обычно создают от четырех до шести. Электролизеру Стэнли Мейера нужна импульсная схема питания, чтобы он работал эффективно.
Этот метод управляет подачей тока в ячейки с определенной частотой и амплитудой. Тем не менее, следует отметить, что до сих пор никто не смог точно воссоздать ячейку Стэнли Мейера, что делает ее загадочным устройством с неизвестными деталями конструкции.
Обвязка для электролизера состоит из нескольких компонентов, которые облегчают и оптимизируют работу устройства. Важно отметить, что эти элементы не являются строго обязательными, но они значительно улучшают функциональность и безопасность электролизера. Вот более подробно о каждом из элементов:. Эти компоненты дополняют электролизер, делая его более безопасным и эффективным для производства и использования газа Брауна или других газов. В импульсной схеме питания, ток подается электролизеру в виде коротких импульсов с заданной частотой и амплитудой.
Эта схема использует высоковольтную схему, вдохновленную подходами, разработанными Стэнли Мейером. Возможно, предпочтительнее будет схема Дэйва Лоутона, которая также часто используется и считается более простой для изготовления.
Плата управления Arduino может быть использована для управления этой схемой. Схема Дэйва Лоутона включает в себя следующие компоненты:.

Для сборки этой схемы необходимо иметь отдельную текстолитовую плату, которую можно заказать в специализированных мастерских или изготовить самостоятельно.
Электролит — это критически важная часть процесса электролиза. Если вы не приготовите качественный электролит, процесс электролиза может не начаться вообще, или начнется с очень низкой скоростью и с большим количеством примесей в выделившемся газе.
В основном для электролиза воды используют растворы щелочей, такие как NaOH гидроксид натрия или KOH гидроксид калия и т. Также можно использовать растворы NaHCO3 пищевая сода или NaCl поваренная соль , но их использование может привести к образованию большого количества осадка, что может негативно сказаться на работе электролизера.
Поэтому рекомендуется использовать водные растворы щелочей для более эффективного процесса электролиза. Вот рецепт подготовки электролита для электролиза воды:. Этот электролит обеспечит хорошую проводимость в реакторе электролиза и позволит вам получить высококачественные результаты при разложении воды на водород и кислород.
Поскольку пластины круглой формы способны выдерживать большее давление, они необходимы для максимизации мощности электролизера. Электролиз работает лучше при высоком давлении. Этот электролизер имеет мощность Ватт. Мощность составляет 1 киловатт, если активная площадь составляет 1 квадратный метр.
Для вычисления массы выделившегося вещества можно использовать формулу Фарадея:. С использованием этой формулы и известных значений электрохимических эквивалентов, силы тока и времени работы, можно определить, какое количество водорода и кислорода будет выделено в результате электролиза.
На Рис. Таким образом, исследование завершено на уровне согласующихся с экспериментом числовых данных, полученных с помощью законов электрохимии. Экспериментально зарегистрированы изменения рН приэлектродных областей в процессе электролиза водного раствора сульфата калия, опытные данные находятся в хорошем соответствии с величинами, вычисленными на основе законов электрохимии.
В операциях электрохимических технологий электросинтез, меднение, никелирование параллельное восстановление или окисление воды на электродах может стать причиной отклонения рН от нормы и привести к нарушению технологического режима.
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания» Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления.
В результате исследований удалось получить экспериментальное подтверждение изменения кислотности приэлектродных зон, зависимость изменения рН католита и анолита от времени электролиза, получены теоретически ожидаемые и практически наблюдаемые значения рН катодной и анодной зон в зависимости от времени электролиза, находящиеся в хорошем соответствии друг с другом.
Исследование завершено на уровне согласующихся с экспериментом числовых данных, полученных с помощью законов электрохимии. Результаты исследования позволяют сделать вывод, что в операциях электрохимических технологий электросинтез, меднение, никелирование параллельное окисление или восстановление воды на электродах может стать причиной отклонения рН от нормы и привести к нарушению технологического режима.
Статья в формате PDF. Ахмедов Н. Багоцкий В. Багоцкий, А. Коровин Н. Лабораторные работы по химии. Макаров В. Макаров, А. Скоргеллети В. Переводная версия журнала "Современные проблемы науки и образования" "Modern Problems of Science and Education. Surgery» ISSN - Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания». Академия Естествознания готовит к изданию реестр новых научных направлений, разработанных российскими учеными.